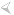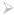Biologia i chemia środowisk ekstremalnych
(Na podstawie artykułu zamieszczonego w dwumiesięczniku LAB 5,6/2009)
Wstęp
Jednym z najstarszych i zarazem najbardziej podstawowych pytań ludzkości jest: Czy istnieje życie w kosmosie? Pytanie to najczęściej jest zadawane w kontekście ostatnich wypraw kosmicznych, jak chociażby misji sondy Mars Express, której głównym zadaniem było poszukiwanie wody na Marsie. Mimo gigantycznego nakładu środków na badania astrobiologiczne wciąż brak jednoznacznej odpowiedzi na to fundamentalne pytanie. Jednocześnie problem istnienia życia na innych planetach nasuwa też wydawałoby się dziwne pytanie: czy „kosmicznych” organizmów nie ma na ziemi? „Kosmicznych” ze względu na warunki, w jakich przyszło im żyć, tak skrajnie różnych od tych, w jakich bytuje gatunek ludzki i większość znanych nam organizmów. Podobnych raczej do tych, jakie mogą występować na planetach i księżycach układu słonecznego i tysięcy innych obiektów tego typu rozsianych po całej galaktyce. Mimo iż badania nad ekstremalnymi środowiskami i ich mieszkańcami zostały rozpoczęte dość niedawno, stanowią źródło wielu odkryć w naukach przyrodniczych. Być może, niektóre z tych ekosystemów stanowią kolebkę życia na Ziemi. W poniższym artykule scharakteryzowane zostaną wybrane środowiska ekstremalne, zamieszkujące je organizmy oraz wybrane przystosowania biochemiczne niezbędne do przetrwania w tak trudnych warunkach.
Życie na dnie
W 1977 roku w okolicach wysp Galapagos prowadzono sponsorowane przez National Oceanic and Atmospheric Administration badania oceanograficzne przy pomocy statku głębinowego „Alvin”. Dno oceaniczne w tym miejscu cechuje wysoka aktywność geologiczna. Jednym z przejawów tej aktywności są potężne kominy hydrotermalne.

(rys 1. Erupcja komina hydrotermalnego w okolicach wysp Galapagos)
Ze względu na ich wygląd nazwane zostały „czarnymi dymiarkami” (ang. Black Smokers). Jakże wielkim zaskoczeniem dla naukowców był fakt, że stanowią one prawdziwe oazy życia w pobliżu oceanicznego dna. Trudno bowiem o warunki bardziej niesprzyjające życiu w klasycznym tego słowa rozumieniu. Głębokość ponad dwóch kilometrów oznacza całkowity brak światła oraz gigantyczne ciśnienie. Oprócz tego stale występująca aktywność geologiczna podgrzewa wodę do temperatury miejscami sięgającej 400°C (istnienie płynnej wody w tych warunkach jest możliwe ze względu na wysokie ciśnienie). Do tego panuje tam bardzo wysokie stężenie soli mineralnych oraz niskie pH, w pobliżu 2,8. Większość tych głębokomorskich oaz jest unikatowa – w podobnych kominach hydrotermalnych, ale w innej części oceanu spotyka się zupełnie inne gatunki. Zawsze jednak pierwszym ogniwem łańcucha pokarmowego są mikroorganizmy chemosyntezujące. Nimi zaś odżywiają się mięczaki, niektóre kraby oraz rurkoczułkowce, będące z kolei pożywieniem dla kolejnego poziomu konsumentów. W rezultacie tworzona jest skomplikowana sieć zależności.

(rys 2. Kolonie rurkoczułkowców zamieszkujących okolice „czarnych dymiarek”)
Kopalnia Mponeng
Kolejnym spektakularnym epizodem w ramach badań nad środowiskami ekstremalnymi były prace prowadzone w 2008 roku w okolicach Johanessburga, w kopalni złota Mponeng. W jednym z nieczynnych szybów odkryto komorę przez wiele milionów lat odizolowaną od świata zewnętrznego. Woda pochodząca z tej komory zawierała osobniki pojedynczego gatunku Desulforudis audaxviator – redukujących siarkę bakterii gram dodatnich.

(rys 3. Zdjęcie mikroskopowe Desulforudis audaxviator)
Ich całkowita izolacja (w przeciwieństwie do ekosystemów głębinowych korzystających z tlenu powstałego w wyniku fotosyntezy) oraz niekorzystne środowisko było powodem wytworzenia niespotykanych nigdzie indziej rozwiązań biochemicznych, wykazujących jednakże pewne podobieństwa do rozwiązań spotykanych u ekstremofilnych archeonów. W przeciwieństwie jednak do tychże archeonów bakterie Desulforudis audaxviator swe przeżycie nie zawdzięczały aktywności hydrotermicznej, a istniejącym w skale źródłom promieniowania. Rozpad promieniotwórczego uranu, toru oraz potasu powodował przedostawanie się z otaczających skał do ich środowiska zarówno związków węgla jak i siarki. Różnorodność związków, z jakich Desulforudis audaxviator może czerpać węgiel jest duża i obejmuje przykładowo: dwutlenek węgla, formaldehyd czy węglany.
Chemiczne źródła energii
Podstawowym warunkiem funkcjonowania każdego ekosystemu jest doprowadzenie do niego energii przez odpowiednich producentów. W większości przypadków jest to energia słoneczna wykorzystywana w procesie fotosyntezy przez glony i rośliny. Obecność światła nie jest jednak warunkiem koniecznym do istnienia życia. Bakterie chemolitotroficzne pobierają energię z utlenienia związków nieorganicznych i redukują produkty asymilacji dwutlenku węgla. W wymienionych wyżej przypadkach mamy do czynienia z mikroorganizmami siarkowymi. Jest to niejednolita systematycznie grupa mikroorganizmów obejmująca zarówno bakterie oraz archeony (organizmy nieposiadające jądra komórkowego niegdyś zaliczane do bakterii, obecnie sądzi się, że powstały równolegle do bakterii). Łączy je wykorzystanie reakcji utleniania związków siarki, jako źródła niezbędnej energii.
Jednym z najlepiej poznanych przedstawicieli bakterii siarkowych jest Thiobacillus Thiooxidans. Jest to bezwzględnie tlenowy autotrof odkryty w silnie kwaśnym środowisku. Jest on w stanie rozwijać się w ośrodku bardzo kwaśnym, którego pH=1! W procesie chemosyntezy może utleniać szereg związków – siarkę pierwiastkową, siarkowodór, czterotioniany oraz tiosiarczany.
Innym przykładem wielkiego przystosowania się bakterii do trudnych warunków jest możliwość korzystania z rodanków jako jednoczesnego źródła węgla, azotu, siarki oraz energii – a więc wszystkich podstawowych składników niezbędnych do rozwoju. Niestety, ta duża uniwersalność opłacana jest niewielką wydajnością chemosyntezy, wynoszącą około 5-9%.
Schemat utlenienia rodanków przez Thiobacillus Thiooxidans:
CNS + 2O2 + 2H2O--> SO4- + NH4- +CO2 + 220 kcal
Conan the bacterium
Ten groźny przydomek nadał bakterii Deinococcus radiodurans jej odkrywca. Było to spowodowane gigantyczną wprost odpornością tego mikroorganizmu na „tortury”, jakim został poddany. Bakteria przeżywała bowiem naświetlenia o dawce 5.000 Gy, a nawet krótkotrwałe do 15.000 Gy (dla porównania „zwykła” bakteria E.coli jest w stanie przeżyć przy dawce 60 Gy a człowiek 10 Gy). Jest również odporna na zanurzenia w ciekłym azocie oraz wystawianie na działanie próżni. Wbrew pozorom nie została ona odkryta w wodach pochodzących z reaktorów jądrowych czy kopalni uranu. Została znaleziona przez przypadek w konserwach. Jej odkrywca, A.W. Anderson, pracujący w Rolniczej Stacji Eksperymentalnej Oregonu w mieście Corvallis, badał możliwość konserwacji żywności za pomocą promieniowania gamma pochodzącego z tzw. bomb kobaltowych. W jednym z serii testów, mimo napromieniowania denko puszki odkształciło się, sugerując wzrost mikroorganizmów. Z przechowywanego w puszce mięsa wyizolowano gatunek Deinococcus radiodurans.

(rys 4. Zdjęcie mikroskopowe Deinoccocus radiodurans)
Długo było tajemnicą źródło tej odporności – wszak w środowisku naturalnym takie promieniowanie nie występuje. Późniejsze badania nad mutantami tego gatunku bakterii dowiodły, że ich wyjątkowa odporność jest „skutkiem ubocznym” mechanizmów zabezpieczających organizmy przed skutkami długotrwałego wysuszenia.
Czy należy obawiać się epidemii powodowanych przez podobne do Deinococcus radiodurans, odporne na „wszystko” bakterie? Na szczęście, nie. Nadmierne rozbudowanie mechanizmów obronnych i naprawczych spowalnia ich rozwój, przez co przegrywają w rywalizacji o pokarm ze swoimi mniej odpornymi kuzynami.
Ochrona materiału genetycznego
Mutacje powstałe w wyniku oddziaływania na materiał genetyczny czynników chemicznych i fizycznych mają dwojaki skutek. Z jeden strony mutacje stanowią czynnik napędowy ewolucji umożliwiający organizmom dostosowanie się do zmian środowiska. Z drugiej strony, występując w większej liczbie, upośledzają metabolizm i prowadzą do śmierci osobniczej. Z tego względu wszystkie żywe organizmy posiadają enzymy odpowiedzialne za naprawę uszkodzeń materiału genetycznego. Ich stosunkowo duża ilość występuje u organizmów dostosowanych do życia w środowisku szczególnie szkodliwym dla DNA. Kilka przykładów podstawowych mechanizmów chroniących przed mutacjami wymieniono poniżej.
Fotoreaktywacja
Promieniowanie UV jest powszechnie wykorzystywane jako środek dezynfekujący. Jest to wynik zdolności tych promieni do katalizowania reakcji uszkadzających DNA. Powstałe uszkodzenie uniemożliwiają zajście replikacji i tym samym doprowadzają do śmierci organizmu (w przypadku organizmów złożonych jak człowiek promienie UV mogą powodować nowotwór). Powszechność światła UV na Ziemi wymusiła powstanie enzymu naprawczego. Jest nim fotoliaza DNA. Najciekawszym aspektem jego funkcjonowania jest fakt, że reakcje naprawy uszkodzenia katalizuje również światło (choć o innej długości fali). Sam jednak enzym jest dalece niewystarczający w przypadku poważnych uszkodzeń DNA.
Naprawa uszkodzeń dwuniciowych
Uszkodzenia obu nici, w efekcie których oba łańcuchy nukleotydowe w podwójnej helisie zostają zerwane, są szczególnie niebezpieczne dla komórki. Niemożliwe jest wtedy „proste” wycięcie uszkodzonej zasady i zastąpienie jej homologiczną do nieuszkodzonej części.
Wyjątkowa odporność Deinococcus radiodurans na promieniowanie jonizujące wymaga, aby istniał sposób naprawy podwójnego przerwania nici u tych organizmów. Okazało się, że co najmniej dwie kopie genomu (D. radiodurans może posiadać nawet cztery kopie genomu w swoim jednokomórkowym ciele) z różnymi uszkodzeniami mogą uformować fragmenty DNA poprzez reakcje hybrydyzacji. Oczywiście posiadanie tak dużej ilości DNA w komórce dla normalnych warunków jest zbędnym zapasem bezpieczeństwa.
Środowiska ekstremalne a powstanie życia
Próba dokładnego odtworzenia przebiegu biogenezy jest zadaniem obecnie niewykonalnym – ze względu na skromność czasu, jakim w przeciwieństwie do natury dysponują badacze oraz skomplikowaniem poszczególnych jej etapów. Jedną z najpopularniejszych hipotez biogenezy jest teoria „płytkiego morza” oparta na wynikach spektakularnego doświadczenia Ureya-Millera. Istnieje również inne teoria zakładająca, że życie powstało tam, gdzie nie należało się go nigdy spodziewać – w okolicach wspomnianych wcześniej kominów hydrotermalnych. Model ten, nazwany „siarkowo-żelazowym”, został opracowany przez niemieckiego chemika Guntera Wächtershäusera.
Zakłada on powstanie pierwszych kompleksów organicznych, będących protoplastami życia, w okolicach ujścia energii geotermicznej, na rozbudowanej powierzchni siarczków żelaza oraz niklu. Jest to hipoteza przyjmująca powstanie pierwowzoru metabolizmu polegającego na szeregu reakcji anabolicznych i katabolicznych w oparciu o gradient temperatury w okolicach komina hydrotermalnego. Przy jego ujściu zachodziłyby, dzięki wysokiej temperaturze i ciśnieniu, reakcje syntezy. Ich produkty dyfundowałyby ku strefie niższej temperatury i osiadały na powierzchni kryształów, przechodząc kolejne przemiany. Cykl ten byłby stabilny w czasie – erupcje wielu kominów są stałe niekiedy przez dziesiątki lat. Dopiero później powstały cząstki mające zdolność regulacji tych reakcji. Podobnie jak Urey i Miller niemiecki badacz wykonał serie doświadczeń mających potwierdzić jego przypuszczenia. W 1997 roku Wächtershäuser i Claudia Huber umieścili między innymi: tlenek węgla, siarkowodór, siarczki niklu i żelaza oraz cyjanek potasu w roztworze wodnym o temperaturze około 100°C. Po pewnym czasie otrzymali mieszaninę zawierającą podstawowe dla organizmów związki chemiczne: amoniak, aminokwasy biogenne oraz kwas cytrynowy i octowy.
Zakończenie
Badania nad możliwościami dostosowania się życia do otoczenia pokazują, jak płynną i elastyczną jest granica przystosowania się organizmów do niesprzyjających warunków. Prowadzone eksperymenty na temat przetrwania przez dłuższy czas mikroorganizmów w głębokiej próżni, uwięzionych w kamiennych asteroidach, wskazują, że przetrwanie to jest możliwe także w przypadku mikroorganizmów obecnie znanych nauce. Dokonać tego mogą organizmy, które w toku ewolucji przez miliony pokoleń wcale nie zostały wyselekcjonowane do istnienia w specyficznych, niesprzyjających warunkach. Dlatego też hipotezy dotyczące istnienia życia na księżycu Saturna – Europie, gdzie pod pokrywą lodową być może kryje się płynna woda oraz miejsca podobnych do ziemskich, podwodnych erupcji wulkanicznych, nie są całkowicie pozbawione podstaw.
Za pomoc oraz cenne uwagi, które przyczyniły się do napisania niniejszego artykułu chciałbym podziękować prof. dr hab. inż. Barbarze Becker oraz Aleksandrze Laskowskiej.
Literatura:
1. H. Hegel, Mikrobiologia ogólna, PWN, Warszawa 2003.
2. W. Kunicki-Goldfinger, Życie bakterii, PWN, Warszawa 1977.
3. E.P. Solomon, L.R. Berg, D.W. Martin, Biologia, MULTICO, Warszawa 2007.
4. L. Stryer, Biochemia, PWN, Warszawa 1999.
5. Biologia molekularna, pod red. Z. Lassoty, PWN, Warszawa 1989.
6. K.E. Nelson, M. Levy, S.L. Miller, PNAS 97 (8):3868–3871.
7. P.B. Sigler, Z. Xu, S.R. Hays, Ann. Rev. Biochem. 1998, 67:581–608.
8. D. Chivian, E.L. Brodie, Science 322 (5899), 275.
9. V. Mattimore, J.R. Battista, J Bacteriol, 1996, 178, 3:633–637.
10. G. Wächtershäuser, Science 289:1307–1308.
11. M. Hanczyc, J.W. Szostak, Chemical Biology 2004, 8:660–664.
12. P. Huyghe, The Sciences, New York Academy of Sciences, 16–19.